ゼブラフィッシュの心臓血管系 – 心拍モニタリング(Cardiology measurements in zebrafish larvae)
新薬の研究は、心血管系の負の副作用のために中止されることが多くなります。 したがって、毒性学および薬理学における多くの研究は、心臓機能に焦点を当てています。 心拍数は重要な変数で、具体的には、このパラメータが遺伝的、生理学的、および薬理学的介入にどのように反応するかが、多くの研究で調査されています。ゼブラフィッシュは、心臓血管研究にとって興味深い種です。 それは開発する最初の器官であり、その発達は人間の心臓のそれに似ています。
ゼブラフィッシュの心臓血管系
ゼブラフィッシュ、特に胚および幼生は、しばしばこのタイプの研究において選択される動物です。 心臓はゼブラフィッシュで最初に発生する器官であり、発達は人間の心臓に似ています。 また、げっ歯類モデルとは異なり、魚は胚発生中の生存のために心臓血管系に依存しません。 したがってその開発の欠陥は、早期死亡および他の問題を引き起こす可能性は低くなります。 それに、ゼブラフィッシュの幼生が透明であるという事実を加えて、ゼブラフィッシュが心臓発達または心臓血管発達の研究に有用である理由を理解することができます。
従来の研究方法
ゼブラフィッシュの心臓系は、しばしば、心拍数または心拍間隔を測定することによって評価される。 従来の方法には、これを手動で(ストップウォッチを使用して)計数すること、マイクロ圧力システム、レーザードップラー顕微鏡、または心電図が含まれる。 これらの方法は労働集約的で時間がかかるものであり、その上で実行するためには特定の訓練が必要です。
映像解析を用いたイメージング法
ビデオ画像解析は、ゼブラフィッシュの幼生の心拍数を正確かつ効率的に評価する方法として使用できます。 DanioScopeは、ビデオ画像を分析し、心拍を正確に抽出する方法を提供します。
ダニオスコープ
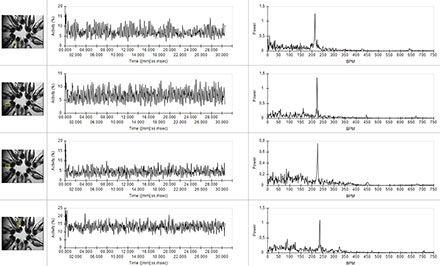
DanioScopeはアクティビティ、つまり、あるフレームから次のフレームへのアクティブピクセルの変化を検出します。 心拍を監視するには、(アリーナとして)心臓領域を定義するだけで、DanioScopeはビデオ中にアクティビティを検出、その後このフレーム内のハートビートを検出します。 同じビデオの同時視聴で複数の稚魚の心拍を検出することができます。
ストレートフォワード
この手法では、必要なのは幼生とDanioScopeのビデオだけとなり、研究室スタッフのための特定のトレーニングの蛍光標識の必要はありません。
実際には
実際には、幼生は通常(例えば、アガロースで)固定され、心臓領域の最適な視野のために横方向に配置されます。 次に、ビデオは、デジタルビデオ顕微鏡を使用して、多くの場合、1人または複数の個人から同時に作られます。 DanioScopeはMPEG1、MPEG2、およびMPEG4ビデオフォーマットをサポートしていますが、ほとんどの標準ビデオフォーマット(MOV、AVI)でも動作します。
参考文献
- Barros, T.P.; Alderton, W.K.; Reynolds, H.M.; Roach, A.G.; Berghmans, S. (2008). Zebrafish: an emerging technology for in vivo pharmacological assessment to identify potential safety liabilities in early drug developmentBritish Journal of Pharmacology, 154, 1400-1413.
- Chan, P.K.; Lin, C.C.; Cheng, S.H. (2009). Noninvasive technique for measurement of heartbeat regularity in zebrafish (Danio rerio) embryos. BMC Biotechnology, 9, 11.
- Denvir, M.A.; Tucker, C.S.; Mullins, J.J. (2008). Systolic and diastolic ventricular function in zebrafish embryos: influence of norepinephrine, MS-222 and temperatureBMC Biotechnology8, 21.
- Fink, M.; Callol-Massot, C.; Chu, A.; Ruiz-Lozano, P.; Izpisua Belmonte, J.C.; Giles, W.; Bodmer, R.; Ocorr, K. (2009) A new method for detection and quantification of heart-beat parameters in Drosophila, zebrafish, and embryonic mouse hearts. Bio Techniques46, 101-113.
- Jacob, E.; Drexel, M.; Schwerte, T.; Pelster, B. (2002). Influence of hypoxia and of hypoxemia on the development of cardiac activity in zebrafish larvae. American Journal of Physiology – Regulatory, Integrative and Comparative Physiology, 283, R911-R917.